倫理指針
第60回日本肝臓学会総会では、JDDW2023倫理指針に基づいて、下記の手順にて手続きをお願いいたします。
Ⅰ.「1.人を対象とする生命科学・医学系研究に関する論理指針(本学会発表や抄録作成,論文投稿において遵守すべきこと)」をお読みください。
Ⅱ.ご自身の発表内容が「2.Medical ethics申請」でどの項目に該当するかをご選択ください(演題応募画面にも同じチェック項目がありますので、その中からご選択ください)。
Ⅲ.ご自身の発表内容がどのような審査を必要とするかについては「3.倫理指針(カテゴリー分類)」のフローチャートに沿って確認のうえ、手続きをお願いいたします。
Ⅳ.その他、不明な点については「4.よくあるご質問(Q&A)」をご確認ください。
2. 演題登録時Medical ethics 申請
演題応募の際には、倫理審査が必要な発表かどうかの申告をしていただきます。下記の申請画面から該当する項目をひとつ選び、申請の上、ご応募いただきますようお願いいたします。
なお、応募時に分かる用フローチャートも用意いたしましたので、チャートに沿って、ご自身の発表がどのような審査を必要とするか、確認をお願いいたします。詳細は「3.発表における生命科学・倫理指針(カテゴリー分類)」の「フローチャート」をご参照ください。
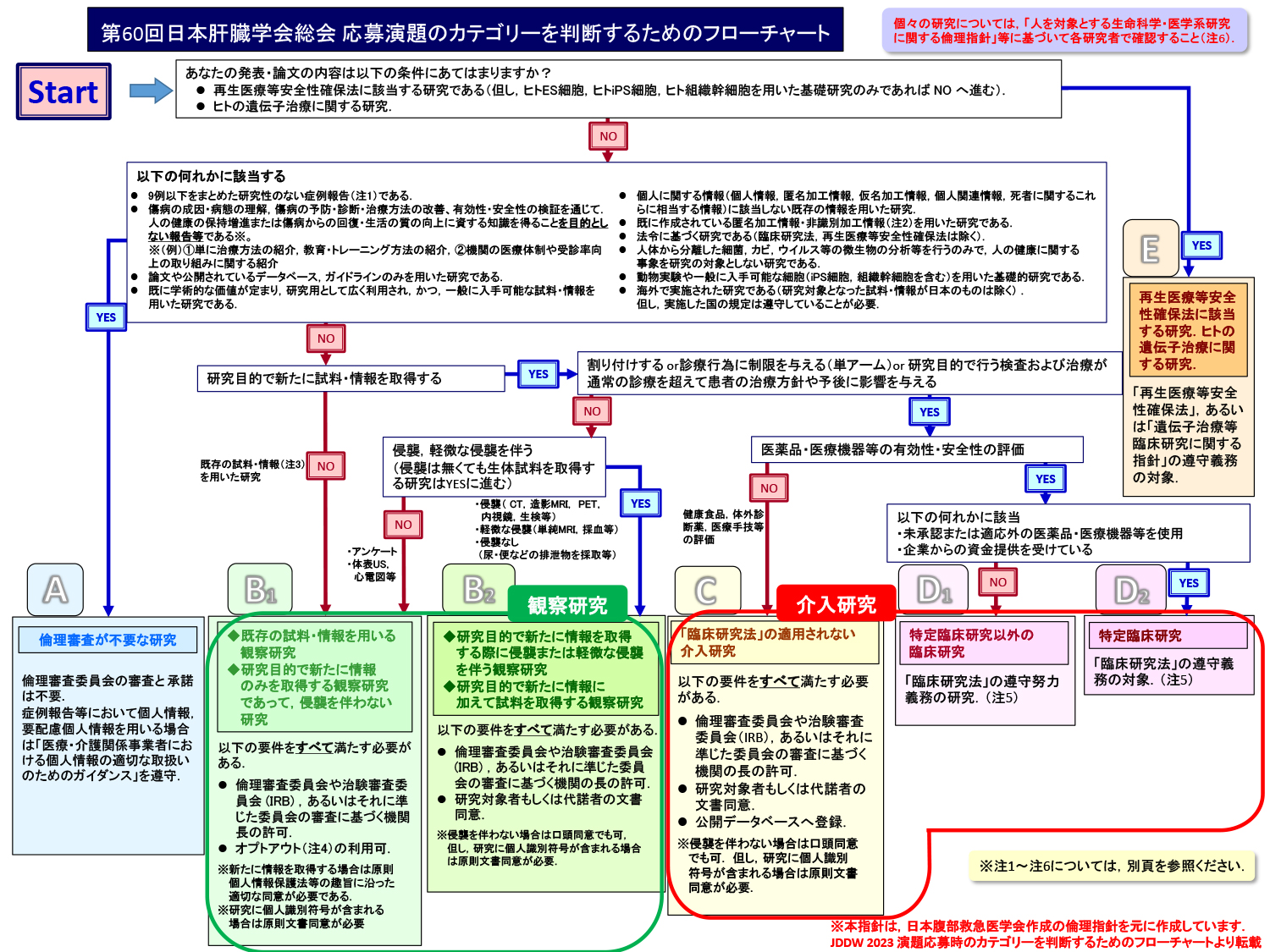
3. 発表における倫理指針(カテゴリー分類)
演題応募時には下記のフローチャートに沿って、ご自身の発表がどのような審査を必要とするか、確認の上、手続きをお願いいたします。
カテゴリー分類・倫理指針から見た研究の種類と必要な手続きにつきましても合わせてご確認ください。
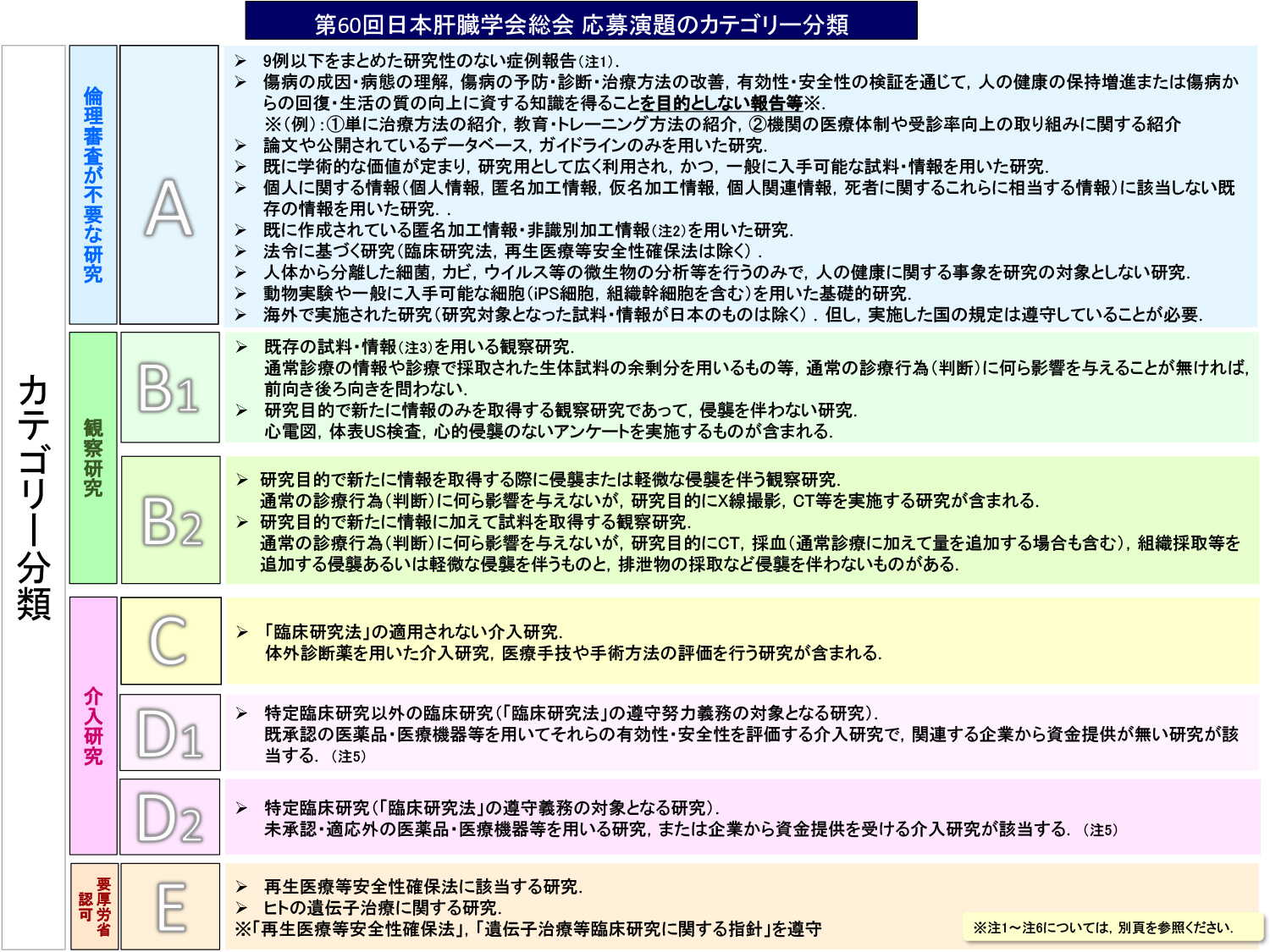
A. 症例報告など倫理審査が不要な研究
- 9例以下をまとめた研究性のない症例報告.
- 傷病の成因・病態の理解,傷病の予防・診断・治療方法の改善,有効性・安全性の検証を通じて,人の健康の保持増進または傷病からの回復・生活の質の向上に資する知識を得ることを目的としない報告等※
※(例):①単に治療方法の紹介,教育・トレーニング方法の紹介,②機関の医療体制や受診率向上の取り組みに関する紹介 - 論文や公開されているデータベース,ガイドラインのみを用いた研究.
- 既に学術的な価値が定まり,研究用として広く利用され,かつ,一般に入手可能な試料・情報を用いた研究.
- 個人に関する情報(個人情報,匿名加工情報,仮名加工情報,個人関連情報,死者に関するこれらに相当する情報)に該当しない既存の情報を用いた研究.
- 既に作成されている匿名加工情報または非識別加工情報を用いた研究.
- 法令に基づく研究(臨床研究法,再生医療等安全性確保法は除く).
- 人体から分離した細菌,カビ,ウイルス等の微生物の分析等を行うのみで,人の健康に関する事象を研究の対象としない研究.
- 動物実験や一般に入手可能な細胞(iPS細胞,組織幹細胞を含む)を用いた基礎的研究.
- 海外で実施された研究(研究対象となった試料・情報が日本のものは除く).但し,実施した国の規定は遵守していることが必要.
B. 観察研究
- B1. ・既存の試料・情報を用いる観察研究
・研究目的で新たに情報のみを取得する観察研究であって、侵襲を伴わない研究 - B2. ・研究目的で新たに情報を取得する際に侵襲または軽微な侵襲を伴う観察研究.
・研究目的で新たに情報に加えて試料を取得する観察研究. - D1. 「臨床研究法」の遵守努力義務の対象となる研究.
既承認の医薬品・医療機器等を用いてそれらの有効性・安全性を評価する介入研究で,関連する企業から資金提供が無い研究が該当する. - D2. 「臨床研究法」の遵守義務の対象となる研究.
未承認・適応外の医薬品・医療機器等を用いる研究,または企業から資金提供を受ける介入研究(特定臨床研究)が該当する.
C.「臨床研究法」の適用されない介入研究
体外診断薬を用いた介入研究、医療手技や手術方法の評価を行う研究が含まれる。
D.「臨床研究法」の対象となる研究
E. 再生医療等安全性確保法に該当する研究.ヒトの遺伝子治療に関する研究
厚生労働大臣の許可を要する.
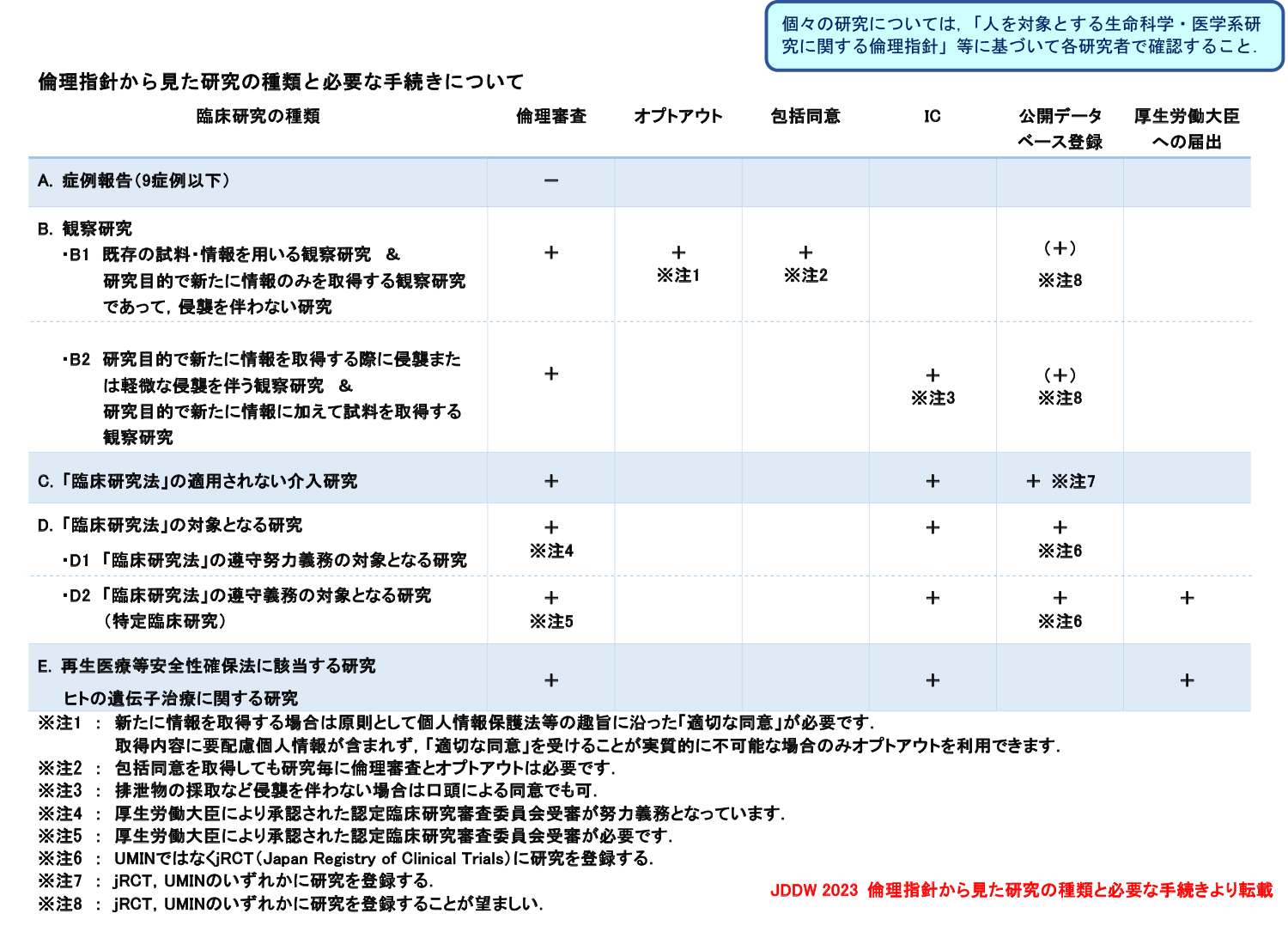
臨床倫理審査
倫理審査委員会や施設内審査委員会 (IRB),あるいはそれに準じた諮問委員会に基づく施設長の許可.
オプトアウト
当該研究について情報を研究対象者等に直接通知するか,または当該施設の掲示板やホームページ上で公開し,研究対象者等が研究への参加を拒否する機会を保障すること.
同時に拒否の意思表示を受け付ける窓口(連絡先)を明示する必要がある.
包括同意
診療情報・人体由来の試料取得時に,利用が明示されている当該研究以外の研究への利用についても文書で同意が与えられていること.
診療の一環として得られる情報・人体由来の試料について,具体的な研究内容を明示せずに将来の研究への利用について文書で同意が与えられていること.但し,それらの試料を用いて実際に研究を行うに際しては,改めて倫理審査委員会の審査に基づく施設長の許可と研究対象者へのオプトアウトが必要.
4. よくあるご質問(Q&A)
①試料・情報の利用目的及び利用方法(他の機関へ提供される場合はその方法を含む.)
②利用または提供する試料・情報の項目
③利用する者の範囲
④試料・情報の管理について責任を有する者の氏名または名称
⑤研究対象者またはその代理人の求めに応じて,研究対象者が識別される試料・情報の利用または他の研究機関への提供を停止すること
⑥⑤の研究対象者またはその代理人の求めを受け付ける方
①9例以下をまとめた症例報告(但し,症例数に関係なく診療の有効性・安全性を評価するなど研究性のあるものは除く)である.
②傷病の成因・病態の理解,傷病の予防・診断・治療方法の改善,有効性・安全性の検証を通じて,人の健康の保持増進または傷病からの回復・生活の質の向上に資する知識を得ることを目的としない報告等である※1.
③論文や公開されているデータベース,ガイドラインのみを用いた研究である.
④既に学術的な価値が定まり,研究用として広く利用され,かつ,一般に入手可能な試料・情報を用いた研究である※2.
⑤個人に関する情報(個人情報,匿名加工情報,仮名加工情報,個人関連情報,死者に関するこれらに相当する情報)に該当しない既存の情報を用いた研究.
⑥既に作成されている匿名加工情報または非識別加工情報を用いた研究である.
⑦法令に基づく研究である(臨床研究法,再生医療等安全性確保法は除く).
⑧人体から分離した細菌,カビ,ウイルス等の微生物の分析等を行うのみで,人の健康に関する事象を研究の対象としない研究である.
⑨動物実験や一般に入手可能な細胞(iPS細胞,組織幹細胞を含む)を用いた基礎的研究である.
⑩海外で実施された研究である(研究対象となった試料・情報が日本のものは除く).但し,実施した国の規定は遵守していることが必要.
上記以外は,必ず倫理審査委員会の審査を受け機関の長の許可が必要です.委員会を常設していない機関からの研究発表については,他機関からの倫理審査を受け付けている委員会で審査を受けて下さい.多機関共同研究の場合は,原則として全ての共同研究機関は研究代表者が審査を受ける倫理審査委員会での一括審査を受ける必要があります.その場合は,所属機関での個別審査は原則不要ですが,機関によっては再度審査が必要な場合もあります.何れであっても,最終的には所属機関の長の許可は必ず必要です.
※1:(例):①単に治療方法の紹介,教育・トレーニング方法の紹介,②機関の医療体制や受診率向上の取り組みに関する紹介
※2:「既に学術的な価値が定まり,研究用として広く利用され,かつ,一般に入手可能な試料・情報」の「既に学術的な価値が定まり」とは,査読された学術論文や関係学会等において一定の評価がなされており,主要ジャーナルにおいて注釈なしに汎用されているようなもの,一般的なものとして価値の定まったものを指します.「研究用として広く利用され」に関しては,例えば,米国の疾病対策センター(CDC)が研究用としてウェブ上にダウンロード可能なかたちで公開している情報のほか,査読された学術論文に掲載されている情報及び当該論文の著者等が公開している原資料で研究用として広く利用可能となっている情報などが該当します.「一般に入手可能な試料・情報」としては,必ずしも販売されているものに限らず,提供機関に依頼すれば研究者等が入手可能なもので,例えば,HeLa 細胞や,ヒト由来細胞から樹立した iPS 細胞のうち研究材料として提供されているものなどが該当しますが,一般的に入手可能か否かは,国内の法令等に準拠して判断します.
研究を行うに際して,改めて倫理審査委員会の審査に基づく機関の長の許可と研究対象者へのオプトアウトが必要です.
注)試料を用いてゲノム解析を行う場合は,同意を受ける際にゲノム解析を行う旨に関する事項の同意を受けていることが原則必要です.
第60回日本肝臓学会総会の演題応募に際しては,第60回日本肝臓学会総会倫理指針上,倫理審査が必要な発表は,必ず所属機関または関連の大学病院・関連学会(学会に研究倫理審査機能がある場合)・医師会等の倫理審査制度を利用し承認を得たうえで演題登録を行って下さい.
なお,消化器内視鏡学会及び消化器がん検診学会では,条件により倫理審査の受託を行っています.詳細は各学会事務局に直接お問い合わせ下さい.
※未承認・適応外の医療が,研究としてではなく医療として実施された場合は,医療法に従って各機関での手続きを経ていることが必要です.
1)関連機関を共同研究機関とする場合(共同演者,共著者になります)
各機関に研究責任者を置き,個々の機関での機関の長の許可が必要です.倫理審査は,研究代表者が審査を受ける倫理審査委員会での一括審査が原則となります.但し機関によっては,再度審査を必要とする場合もあります.
2)関連機関を試料・情報の提供のみを行う機関(既存の試料・情報の提供のみを行う機関)とする場合(共同演者,共著者になりません)
匿名化された状態の試料・情報を提供する場合,関連機関の倫理審査は不要で(この場合であっても倫理審査委員会で審査をすることになっている機関もありますので,各機関のルールに従って下さい),提供元の機関の長が把握していれば情報を取得することは可能です.但し,研究実施機関の研究責任者は,提供元の機関が適正に試料・情報を提供するために必要な体制及び規程の整備が行われていることを確認する必要があります(提供先の機関の体制によっては,研究に関しての通知・公開が必要な場合もあります).
※匿名化が困難な情報が含まれる場合は倫理審査が必要となります.
診療として行う採血の際に,研究目的で上乗せして採血量を増やす場合や,研究目的のみで採血をする場合であっても,一般健康診断で行われる程度の採血であれば,「軽微な侵襲」と判断してよい.
但し,前者の場合であって,明らかに研究対象者の身体に影響があると考えられる採血量の増加を伴うものや,後者の場合であって,一般健康診断で行われる採血量を超えるものに関しては,「侵襲あり」と判断されます.
(参照8. Question)
※未承認・適応外の医療が,研究としてではなく医療として実施された場合は,医療法に従って各機関での手続きを経ていることが必要です.
2)研究としてこの治療を実施する場合は,「特定臨床研究」に該当し「臨床研究法」の対象となります.法に基づいた手続きを経てから実施して下さい.
※研究目的で,医薬品や医療機器等を未承認あるいは適応外で使用する研究は,「特定臨床研究」であり,「臨床研究法」の遵守義務対象となります.また,既承認,承認範囲内のものであっても,医薬品や医療機器等の有効性や安全性を評価する場合も「臨床研究法」の遵守努力義務対象となります.なお,企業等から資金提供を受けた医薬品や医療機器等の研究は,対象となる医薬品や医療機器等の承認の有無や適応範囲に関わらず,「特定臨床研究」であり,「臨床研究法」の遵守義務対象となります.
ただ,プライバシー等の観点からも可能であれば,文書にて同意を得ているとより良いと考えます.
またこの場合,包括同意を得たもので代用できます.包括同意とは診療情報や診療の一環として採取された検体(試料)を,将来にわたって様々な研究に利用させていただくことを書面で予め同意いただくものを指します.
「匿名化されているもの」には復元が不可能なものと可能なものとで扱いが異なることに注意して下さい.
参照:
①復元不可能なもの(特定の個人を識別することができないものに限る.):ⅰ)もともと対応表が作成することなく匿名化した情報,ⅱ)提供元の機関で対応表を作成してあったが,規定された保存期間を過ぎて対応表が破棄されてしまった匿名化情報.
②復元可能なもの(どの研究対象者の試料・情報であるかが直ちに判別できないよう,加工または管理されたものに限る.):匿名化された情報であり,その情報だけでは個人を特定できないが,対応表が存在し,照合するなど何らかの手段を講じることにより,誰の情報であるかを特定可能な情報.この場合,対応表の存在は,自機関のみには限らない.
個人情報保護法で規定される個人情報の記述等の一部(個人識別符号に関しては全部)を削除する(当該一部の記述等を復元することのできる規則性を有しない方法により他の記述等に置き換えることを含む)ことにより,特定の個人を識別することができないように匿名加工基準に従って加工して得られる個人に関する情報であって,当該個人情報を復元することができないようにしたものをいいます.
(例)民間事業者等が保有している個人にヒモづいた情報を加工して他の事業者に提供する際の情報.
●非識別加工情報:
行政機関または独立行政法人等の保有する個人情報で,非識別加工情報に係る加工対象とされる個人情報の記述等の一部(個人識別符号に関しては全部)を削除する(当該一部の記述等を復元することのできる規則性を有しない方法により他の記述等に置き換えることを含む)ことにより,特定の個人を識別することができないように匿名加工基準に従って加工して得られる個人に関する情報であって,当該個人情報を復元することができないようにしたものをいいます.
(例)行政機関等に請求して取得する情報.
・住民台帳を基にして,個人情報が加工された地域の家族構成の情報を取得.
・介護保険情報を基にして,個人情報が加工された地域の介護状況の情報を取得.
なお,医学系倫理指針の適用外となるのは,既に作成されている「匿名加工情報」「非識別加工情報」であるので注意して下さい.
※レセプト情報・特定健診等情報データベース(NDB)のデータを利用する際は,倫理審査委員会の承認が必要です.但し,NDBオープンデータを用いた研究は,公開されているデータを用いた研究であり,倫理審査委員会の審査は不要です.
参考:
個人情報の保護に関する法律についてのガイドライン(仮名加工情報・匿名加工情報編)(平成28年11月(令和3年10月一部改正) 個人情報保護委員会)https://www.ppc.go.jp/files/pdf/220908_guidelines04.pdf
個人情報保護委員会事務局提出資料PDF<総務省 公表資料>http://www.soumu.go.jp/main_content/000570869.pdf
上記以外の場合であっても,当該研究の目的と相当の関連性がある別研究等で既に同意を取得済みのものであれば,通知・公開のみで同意は不要です.それ以外の研究は,原則ICが必要ですが,ICの取得が実質困難な場合はオプトアウトでICに変えることが可能です.
上記何れの場合でも,新たに個人識別符号に該当するゲノムデータを取得する場合は,原則文書同意が必要となります.
他方,保健事業により得られた人の健康に関する情報や検体を用いて,生活習慣病の病態の理解や予防方法の有効性の検証などは,「研究」に該当し,倫理審査が必要となります.
※なお,「人を対象とする生命科学・医学系研究に関する倫理指針(文科省・厚労省・経産省)」では,以下の場合は重大な指針不適合となり,機関の長は厚生労働大臣への報告が義務付けられています.
①倫理審査委員会の審査または研究機関の長の許可を受けずに,研究を実施した場合
②必要なインフォームド・コンセントの手続を行わずに研究を実施した場合
③研究内容の信頼性を損なう研究結果のねつ造や改ざんが発覚した場合
また,「特定臨床研究」に関して違反があった場合は,「臨床研究法」違反となり,研究責任者は処罰の対象となることがあります.
※本Q&Aは,JDDW2023倫理指針を元に作成しています.